Terminale > Mission Bac Physique-Chimie > Mes sujets de bac > Constitution et transformation de la matière
CONSTITUTION ET TRANSFORMATION DE LA MATIÈRE
Exercice d'application
Annales PC
-
Contrôle de la qualité d'un biberon (partie C)
Chez le nourrisson, les ions nitrate (NO3-) sont incriminés dans la survenue de la méthémoglobinémie (ou maladie bleue). La formation des ions nitrite, à partir des ions nitrate ingérés, est réalisée par la flore bactérienne intestinale. Chez les enfants, les ions nitrite en excès provoquent une moindre capacité des globules rouges à fixer et transporter l’oxygène.
C'est pourquoi la concentration en ions nitrate dans l'eau potable est réglementée, notamment pour la préparation des biberons.
L’Organisation Mondiale de la Santé (OMS) a fixé la concentration maximale en ions nitrate dans l’eau à 50 mg·L-1.
Par ailleurs, indépendamment de la quantité d’ions nitrate, l’état de conservation d’un lait s’apprécie en mesurant son acidité.
Dans cet exercice, on se propose de :
- vérifier par deux méthodes différentes si une eau supposée potable prélevée au robinet satisfait ou non à la recommandation de l’OMS concernant les nitrates (partie A et partie B) ;
- déterminer combien de temps un biberon préparé peut être conservé avant consommation (partie C).
Partie C - Combien de temps peut-on conserver un biberon préparé avec du lait en poudre ?
On prépare un biberon par dissolution de lait en poudre dans de l’eau.
Un lait présente une légère acidité qui peut se développer assez vite selon les conditions de conservation. En effet, le lactose présent dans le lait se transforme progressivement en acide lactique.
On vérifie l’état de conservation d’un lait en mesurant son acidité exprimée en degré Dornic (°D). Un degré Dornic, noté 1°D, correspond à 0,10 g d’acide lactique par litre de lait.
Données
- Formule semi-développée de l’acide lactique :
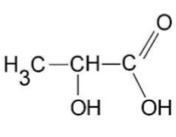
- Masse molaire de l’acide lactique : $M = 90,0$ g·mol-1
- pKa (acide lactique/ion lactate) $= 3,9$
- Couples acide/base de l’eau : H3O+(aq)/H2O(l) H2O(l)/HO-(aq)
- Rappel : pKa = - logKaLe couple acide lactique / ion lactate
10. Recopier la formule semi-développée de l’acide lactique, entourer les groupes caractéristiques et indiquer leur nom.
11. Représenter le schéma de Lewis de l’ion lactate, base conjuguée de l’acide lactique.
Pour la suite, on note AH l’acide lactique et A- sa base conjuguée. La réaction chimique entre l’acide lactique AH et l’eau du biberon conduit à un équilibre chimique :
AH(aq) + H2O(l) ⇌ A-(aq) + H3O+(aq)
La mesure au laboratoire du pH du lait contenu dans le biberon indique un pH = 6,2.
12. Après avoir représenté le diagramme de prédominance du couple AH/A-, indiquer quelle espèce prédomine dans le lait du biberon.
13. Exprimer la constante d’acidité $K$ du couple AH/A- en fonction des concentrations [AH], [A-], [H3O+] et c° avec c° = 1 mol·L-1, concentration standard.
14. En déduire que la concentration en ion lactate [A-] dans le lait du biberon est environ 200 fois supérieure à celle en acide lactique [AH].
Dosage de l’acide lactique
Afin de déterminer la concentration en acide lactique dans le lait, on met en œuvre le protocole suivant :
- Verser dans un erlenmeyer $V_L$ = 40,0 mL de lait.
- Ajouter $V_{eau}$ = 150 mL d’eau distillée.
- Ajouter quelques gouttes d’indicateur coloré (qui permettront de repérer l’équivalence).
- Placer l’erlenmeyer sous une burette remplie de solution d’hydroxyde de sodium (Na+, HO-) de concentration $c_B = 2,0·10^{-2}$ mol·L-1 et agiter.
- Verser jusqu’au changement de couleur et noter le volume de soude versé $V_{BE}.$Pour un même échantillon de lait, on recommence la manipulation plusieurs fois. Les valeurs de $V_{BE}$ ainsi obtenues sont regroupées dans le tableau ci-dessous.
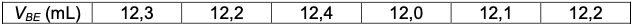
La valeur moyenne de ces valeurs est $\overline{V_{BE}} = 12,2$ mL.
Au cours de la transformation, les couples acide-base mis en jeu sont : AH/A- et H2O/HO-.
15. Écrire la réaction support du dosage.
16. Déterminer la concentration en masse d’acide lactique dans le lait de biberon.
La dispersion des mesures de $V_{BE}$ peut s’expliquer par des imprécisions sur les valeurs de certains paramètres.
17. Parmi les deux paramètres suivants, volume de lait, $V_L,$ et volume d’eau distillée, $V_{eau},$ indiquer lequel a une incidence sur la valeur de $V_{BE}.$
Suivi temporel de la concentration en acide lactique dans plusieurs échantillons
Des tests ont été effectués sur trois échantillons provenant du lait d’un biberon classique préparé par dissolution de lait en poudre dans de l’eau. Ces échantillons ont ensuite été stockés pendant plusieurs jours aux températures suivantes :
- Echantillon 1 : 5 °C.
- Echantillon 2 : 20 °C.
- Echantillon 3 : 30 °C.Un suivi par titrage a permis de déterminer la concentration en masse d’acide lactique dans chaque échantillon en fonction du temps. Les résultats obtenus sont présentés ci-dessous (figure 3). Chaque courbe correspond à l’un des échantillons étudiés.
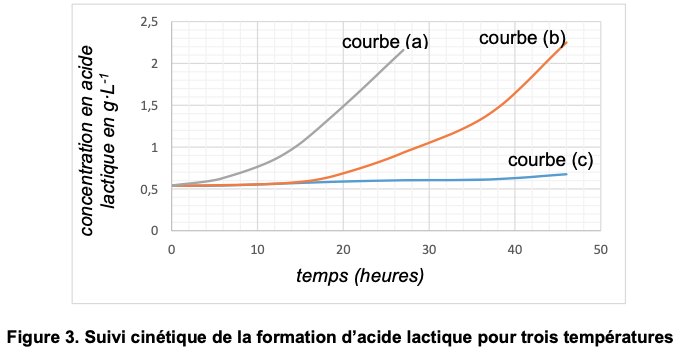
Un lait est considéré comme frais, selon les normes en vigueur, si son acidité est inférieure à 18°D.
18. À l’aide du graphe de la figure 3, déterminer au bout de combien de temps les échantillons 2 et 3 ne sont plus considérés comme étant des laits frais.
22 éléments
-
1  Constitution et transformation de la matière
Constitution et transformation de la matière
-
2  Constitution et transformation de la matière
Constitution et transformation de la matière
-
3  Constitution et transformation de la matière
Constitution et transformation de la matière
-
4  Constitution et transformation de la matière
Constitution et transformation de la matière
-
5  Constitution et transformation de la matière
Constitution et transformation de la matière
-
6  Constitution et transformation de la matière
Constitution et transformation de la matière
-
7  Constitution et transformation de la matière
Constitution et transformation de la matière
-
8  Constitution et transformation de la matière
Constitution et transformation de la matière
-
9  Constitution et transformation de la matière
Constitution et transformation de la matière
-
10  Constitution et transformation de la matière
Constitution et transformation de la matière
-
11  Constitution et transformation de la matière
Constitution et transformation de la matière
-
12  Constitution et transformation de la matière
Constitution et transformation de la matière
-
13  Constitution et transformation de la matière
Constitution et transformation de la matière
-
14  Constitution et transformation de la matière
Constitution et transformation de la matière
-
15  Constitution et transformation de la matière
Constitution et transformation de la matière
-
16  Constitution et transformation de la matière
Constitution et transformation de la matière
-
17  Constitution et transformation de la matière
Constitution et transformation de la matière
-
18  Constitution et transformation de la matière
Constitution et transformation de la matière
-
19  Constitution et transformation de la matière
Constitution et transformation de la matière
-
20  Constitution et transformation de la matière
Constitution et transformation de la matière
-
21  Constitution et transformation de la matière
Constitution et transformation de la matière
-
22  Constitution et transformation de la matière
Constitution et transformation de la matière
