Terminale > Mission Bac Physique-Chimie > Mes sujets de bac > Constitution et transformation de la matière
CONSTITUTION ET TRANSFORMATION DE LA MATIÈRE
Exercice d'application
Annales
-
Certains actes médicaux sont douloureux ; le confort du patient peut être amélioré par une anesthésie locale.
L’objectif de cet exercice est d’étudier la synthèse d’un anesthésiant, la lidocaïne, et quelques caractéristiques d’une crème anesthésiante contenant ce principe actif.
Données :
- masse molaire moléculaire de la lidocaïne : 234,3 g.mol-1 ;
- le rendement usuel de la synthèse de la lidocaïne est supérieur à 70 % ;
- masse volumique de la crème anesthésiante : ρc = 1,0 g.cm-3.
1. Étude de la molécule de lidocaïne
Formules topologiques de la lidocaïne
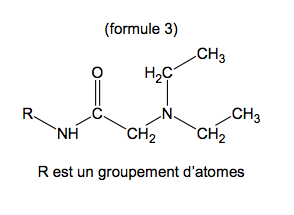
Formule semi-développée simplifiée de la lidocaïne
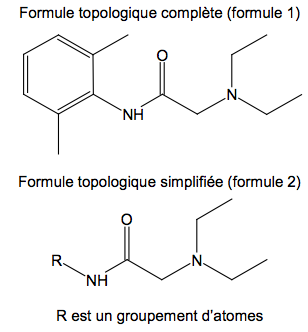
1.1. Recopier la formule topologique simplifiée de la molécule de lidocaïne (formule 2), entourer les groupes caractéristiques et nommer les familles chimiques correspondantes.
Le tableau ci-dessous résume certaines informations contenues dans le spectre de RMN du proton de la lidocaïne. Les protons du groupement d’atomes R ne sont pas pris en compte.
Déplacement chimique
Multiplicité des signaux
δ = 1,1 ppm
triplet
δ = 2,7 ppm
quadruplet
δ = 3,2 ppm
singulet
δ = 8,9 ppm
singulet
1.2. Recopier la formule semi-développée simplifiée de la molécule de lidocaïne (formule 3). Identifier sur cette formule le(s) groupe(s) de protons équivalents correspondant au quadruplet situé à 2,7 ppm et ceux correspondant au triplet situé à 1,1 ppm sur le spectre de RMN. Justifier.
2. Synthèse de la lidocaïne
L’équation de la réaction de synthèse de la lidocaïne est la suivante :
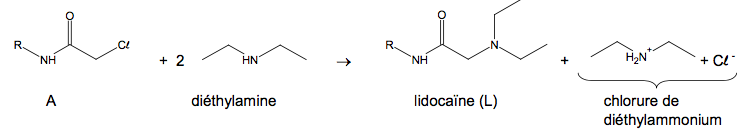
Protocole expérimental de la synthèse :
-
Étape 1 : introduire 6,0 g (3,0 × 10-2 mol) de N-(2,6-diméthylphényl) chloroacétamide, noté A, dans un ballon de 250 mL. Ajouter 60 mL de toluène (solvant) et 15 mL (1,5 × 10-1 mol) de diéthylamine puis chauffer à reflux sous agitation pendant 1 h 30 min.
-
Étape 2 : après élimination de la diéthylamine restante et du chlorure de diéthylammonium formé du mélange réactionnel, traiter le milieu restant par ajout de 30 mL d’une solution aqueuse d’acide chlorhydrique concentré. À l’aide d’une ampoule à décanter, récupérer la phase aqueuse qui renferme la forme acide associée à la lidocaïne synthétisée.
-
Étape 3 : faire précipiter la lidocaïne à l’aide d’une solution d’hydroxyde de sodium.
-
Étape 4 : après filtration et séchage, on obtient une masse de lidocaïne mL = 5,6 g.
2.1. Mise en œuvre du protocole expérimental
2.1.1. Indiquer l’intérêt du chauffage à reflux utilisé dans l’étape 1.
2.1.2. Vérifier que le réactif A est le réactif limitant du protocole mis en œuvre.
2.1.3. Déterminer la valeur du rendement de la synthèse effectuée. Commenter.
2.2. Mécanisme réactionnel de la synthèse
Première étape du mécanisme de la synthèse de la lidocaïne :
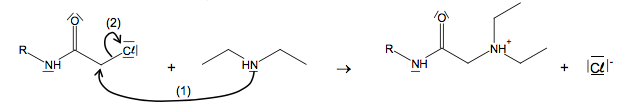
2.2.1. Que représentent les flèches courbes figurant sur cette première étape du mécanisme ?
2.2.2. Identifier le site accepteur et le site donneur associés à la flèche (1).
3. Étude d’une crème anesthésiante
La crème étudiée contient 2,5 % en masse de lidocaïne.
Lorsque la crème est appliquée sur la peau, les principes actifs diffusent à travers les couches de la peau avant d’atteindre des terminaisons nerveuses. On admet qu’une quantité de 10-7 mol de lidocaïne par cm2 de peau est suffisante pour l’anesthésie. L’épaisseur de crème généralement appliquée sur la peau est de l’ordre de 1 mm.
3.1. Vérifier que la quantité de matière de lidocaïne dans la crème étudiée est égale à 1,1 × 10-4 mol par centimètre cube de crème.
3.2. Montrer qu’une épaisseur de 0,1 mm de crème anesthésiante sur une zone de 1 cm2 de peau est suffisante pour anesthésier cette zone.
-
22 éléments
-
1  Constitution et transformation de la matière
Constitution et transformation de la matière
-
2  Constitution et transformation de la matière
Constitution et transformation de la matière
-
3  Constitution et transformation de la matière
Constitution et transformation de la matière
-
4  Constitution et transformation de la matière
Constitution et transformation de la matière
-
5  Constitution et transformation de la matière
Constitution et transformation de la matière
-
6  Constitution et transformation de la matière
Constitution et transformation de la matière
-
7  Constitution et transformation de la matière
Constitution et transformation de la matière
-
8  Constitution et transformation de la matière
Constitution et transformation de la matière
-
9  Constitution et transformation de la matière
Constitution et transformation de la matière
-
10  Constitution et transformation de la matière
Constitution et transformation de la matière
-
11  Constitution et transformation de la matière
Constitution et transformation de la matière
-
12  Constitution et transformation de la matière
Constitution et transformation de la matière
-
13  Constitution et transformation de la matière
Constitution et transformation de la matière
-
14  Constitution et transformation de la matière
Constitution et transformation de la matière
-
15  Constitution et transformation de la matière
Constitution et transformation de la matière
-
16  Constitution et transformation de la matière
Constitution et transformation de la matière
-
17  Constitution et transformation de la matière
Constitution et transformation de la matière
-
18  Constitution et transformation de la matière
Constitution et transformation de la matière
-
19  Constitution et transformation de la matière
Constitution et transformation de la matière
-
20  Constitution et transformation de la matière
Constitution et transformation de la matière
-
21  Constitution et transformation de la matière
Constitution et transformation de la matière
-
22  Constitution et transformation de la matière
Constitution et transformation de la matière
