Terminale > Mission Bac Physique-Chimie > Mes sujets de bac > Constitution et transformation de la matière
CONSTITUTION ET TRANSFORMATION DE LA MATIÈRE
Exercice d'application
Annales PC
-
Contrôle de la qualité d'un biberon (partie B)
Chez le nourrisson, les ions nitrate (NO3-) sont incriminés dans la survenue de la méthémoglobinémie (ou maladie bleue). La formation des ions nitrite, à partir des ions nitrate ingérés, est réalisée par la flore bactérienne intestinale. Chez les enfants, les ions nitrite en excès provoquent une moindre capacité des globules rouges à fixer et transporter l’oxygène.
C'est pourquoi la concentration en ions nitrate dans l'eau potable est réglementée, notamment pour la préparation des biberons [...].
L’Organisation Mondiale de la Santé (OMS) a fixé la concentration maximale en ions nitrate dans l’eau à 50 mg·L-1.
Par ailleurs, indépendamment de la quantité d’ions nitrate, l’état de conservation d’un lait s’apprécie en mesurant son acidité.
Dans cet exercice, on se propose de :
- vérifier par deux méthodes différentes si une eau supposée potable prélevée au robinet satisfait ou non à la recommandation de l’OMS concernant les nitrates (partie A et partie B) ;
- déterminer combien de temps un biberon préparé peut être conservé avant consommation (partie C).
Partie B - Dosage par titrage conductimétrique des ions nitrate dans l’eau étudiée
Une autre méthode de dosage consiste à faire réagir les ions nitrate, NO3-, en milieu acide, avec une quantité connue d’ions Fe2+. Cette quantité notée n(Fe2+)totale est largement suffisante pour consommer tous les ions nitrate : c’est l’étape 1.
On titre ensuite les ions Fe2+ en excès (qui n’ont pas réagi précédemment) à l’aide d’un dosage par titrage conductimétrique : c’est l’étape 2.
Données
- Masses molaires :
M(NO3-) = 62,0 g·mol-1 ; M(Fe2+) = 55,8 g·mol-1 ; M(Cr2O72-) = 216 g·mol-1
- Protocole du titrage :
ÉTAPE 1 : on prélève un volume $V = 250,0 \pm 0,2$ mL de l’eau étudiée dans la partie A. On fait réagir ce volume avec une solution acidifiée contenant n(Fe2+)totale = 4,0×10-3 mol d’ions Fe2+.
L’équation de la réaction est la suivante :
NO3-(aq) + 3 Fe2+(aq) + 4 H3O+(aq) -> NO(g) + 3 Fe3+(aq) + 6 H2O(l) (équation 1)
On note n(Fe2+)excès la quantité de matière en ions Fe2+ encore présente à l’état final de la réaction d’équation 1.
ÉTAPE 2 : la quantité de matière n(Fe2+)excès est déterminée à l’aide d’un titrage par les ions dichromate Cr2O72- d’une solution aqueuse de dichromate de potassium pour laquelle [Cr2O72-] = C = 5,0×10-2 $\pm$ 0,2×10-2 mol·L-1.
L'équation de la réaction support de ce titrage s'écrit :
Cr2O72-(aq) + 6 Fe2+(aq) + 14 H3O+(aq) -> 2 Cr3+(aq) + 6 Fe 3+(aq) + 21 H2O (l) (équation 2)
La courbe du titrage obtenue est présentée dans la figure 2 ci-dessous.
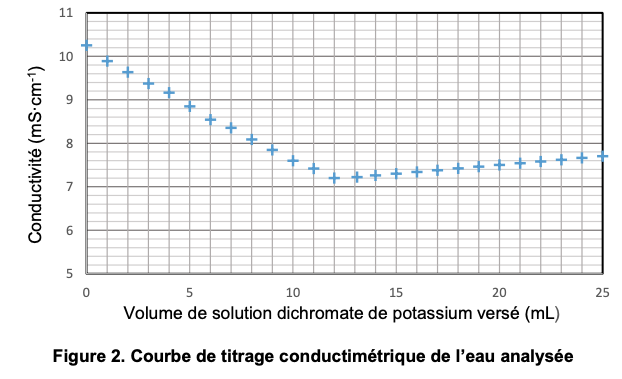
4. Identifier le réactif titré et le réactif titrant lors du titrage de l’ÉTAPE 2.
5. À partir de l’exploitation de la figure 2, montrer que la quantité de matière des ions Fe2+ qui ont été versés en excès n(Fe2+)excès vaut environ 3,6 mmol.
La quantité d’ions nitrate recherchée n(NO3-) peut être calculée à partir de la quantité d’ions Fe2+ initialement introduite lors de l’ÉTAPE 1, n(Fe2+)totale, et à partir de la quantité d’ions Fe2+ titrée lors du titrage n(Fe2+)excès en utilisant la relation suivante :
$n(NO^-_3) = \dfrac{1}{3} [n(Fe^{2+})_{totale} – n(Fe^{2+})_{excès}]$
6. Justifier cette relation.
7. Calculer la quantité d’ion nitrate n(NO3-) présente dans l’échantillon d’eau. En déduire que la concentration en masse en ion nitrate $t_2$ vaut environ 33 mg·L-1.
L’incertitude-type $u(t_2)$ sur la valeur de la concentration $t_2$ de nitrates déterminée avec le titrage est donnée par la relation :
$ u(t_2)=t_2 \times \sqrt{(\dfrac{u(C)}{C})^2+(\dfrac{u(V_E)}{V_E})^2+ (\dfrac{u(V)}{V})^2}$
avec :
- $u(V_E)$ = 0,5 mL, incertitude-type sur la valeur du volume $V_E$ de solution titrante versée à l’équivalence.
- $u(V)$, incertitude-type sur la valeur du volume de solution titrée $V.$
- $u(C)$, incertitude-type sur la valeur de la concentration en quantité de matière [Cr2O72-] = C en ions dichromate Cr2O72-8. Calculer l’incertitude-type $u(t_2)$ de la teneur en ions nitrate puis donner un encadrement de la concentration en masse $t_2$ obtenue avec cette méthode de titrage.
9. Conclure sur la potabilité de l’eau prélevée au regard des résultats obtenus par les deux méthodes de dosage étudiées.
22 éléments
-
1  Constitution et transformation de la matière
Constitution et transformation de la matière
-
2  Constitution et transformation de la matière
Constitution et transformation de la matière
-
3  Constitution et transformation de la matière
Constitution et transformation de la matière
-
4  Constitution et transformation de la matière
Constitution et transformation de la matière
-
5  Constitution et transformation de la matière
Constitution et transformation de la matière
-
6  Constitution et transformation de la matière
Constitution et transformation de la matière
-
7  Constitution et transformation de la matière
Constitution et transformation de la matière
-
8  Constitution et transformation de la matière
Constitution et transformation de la matière
-
9  Constitution et transformation de la matière
Constitution et transformation de la matière
-
10  Constitution et transformation de la matière
Constitution et transformation de la matière
-
11  Constitution et transformation de la matière
Constitution et transformation de la matière
-
12  Constitution et transformation de la matière
Constitution et transformation de la matière
-
13  Constitution et transformation de la matière
Constitution et transformation de la matière
-
14  Constitution et transformation de la matière
Constitution et transformation de la matière
-
15  Constitution et transformation de la matière
Constitution et transformation de la matière
-
16  Constitution et transformation de la matière
Constitution et transformation de la matière
-
17  Constitution et transformation de la matière
Constitution et transformation de la matière
-
18  Constitution et transformation de la matière
Constitution et transformation de la matière
-
19  Constitution et transformation de la matière
Constitution et transformation de la matière
-
20  Constitution et transformation de la matière
Constitution et transformation de la matière
-
21  Constitution et transformation de la matière
Constitution et transformation de la matière
-
22  Constitution et transformation de la matière
Constitution et transformation de la matière
