Terminale > Mission Bac Physique-Chimie > Mes sujets de bac > Constitution et transformation de la matière
CONSTITUTION ET TRANSFORMATION DE LA MATIÈRE
Exercice d'application
Observer : Ondes et matière
-
Exercice : L'alanine en infrarouge - Annale Bac
L’alanine, acide aminé créé dans les cellules musculaires, a été isolée dès 1879. Actuellement, elle peut être synthétisée et utilisée dans la fabrication de produits pharmaceutiques. Les spectroscopies IR et RMN s’avèrent alors des techniques privilégiées pour analyser les produits obtenus.
Données :
Masses molaires atomiques :
$M(C) = 12 \ g.mol^{-1}$
$M(H) = 1 \ g.mol^{-1}$
$M(Br) =80 \ g.mol^{-1}$
$M(N) = 14 \ g.mol^{-1}$
$M(O) = 16 \ g.mol^{-1}$Bandes d'absorption IR de quelques liaisons :
Liaison Nombres d'onde ($cm^{-1}$) $C-H$ $2850-3020$ $C=O$ (aldéhyde) $1720 - 1740$ $C=0$ (acide carboxylique) $1700 - 1720$ $C=0$ (ester) $1735 - 1750$ $C=0$ (acide aminé) $1590 - 1600$ $O-H$ (acide carboxylique) $2500 – 3300$ (bande large) $O-H$ (alcool) $3200 - 3550$ $N-H$ (amine) $3250-3400$ $N-H$ (acide aminé) $2600-3100$ Partie 1 - L'alaline
La formule semi-développée de l'alanine est :
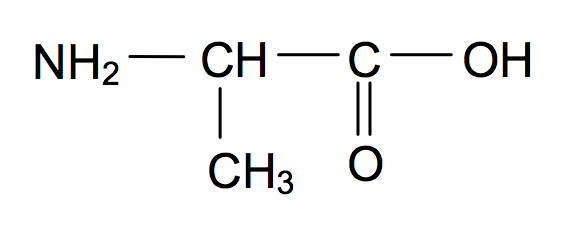
1) Molécule d'alanine
A) Justifier que le nom donné à l'alanine en nomenclature officielle est l'acide 2-aminopropanoïque.
B) Pourquoi l'alanine présente-t-elle des stéréoisomères ? Donner leur représentation de Cram et préciser le type de relation de stéréoisomérie qui les lie.
2) Synthèse de l'alanine
L'une des voies de synthèse de l'alaline consiste à faire réagir l'ammoniac avec l'acide 2-bromopropanoïque. Le bilan de la synthèse peut être modélisé par la réaction chimique d'équation :
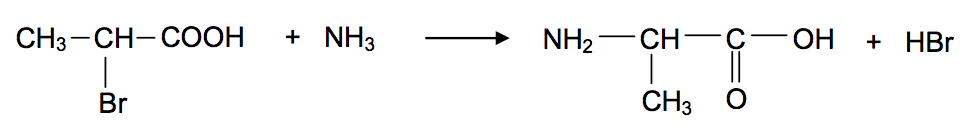
A) Déterminer la catégorie de cette réaction.
B) Dans les conditions opératoires choisies pour la synthèse, le rendement est de $80 \%$, l’ammoniac, réactif le moins onéreux, étant mis en excès. Quelle masse d’acide 2-bromopropanoïque faut-il utiliser pour synthétiser $1,0 \ kg$ d’alanine ?
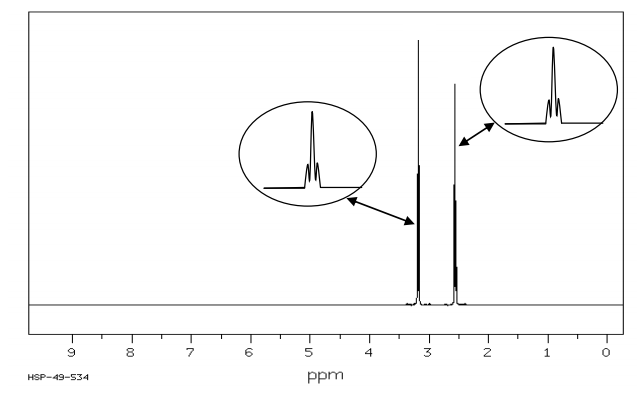
3) Spectres IR et RMN du proton de l’alanine
On dispose des spectres IR et RMN du proton de deux composés dont l’un des deux est l’alanine. Identifier les spectres correspondant à l’alanine. Justifier.
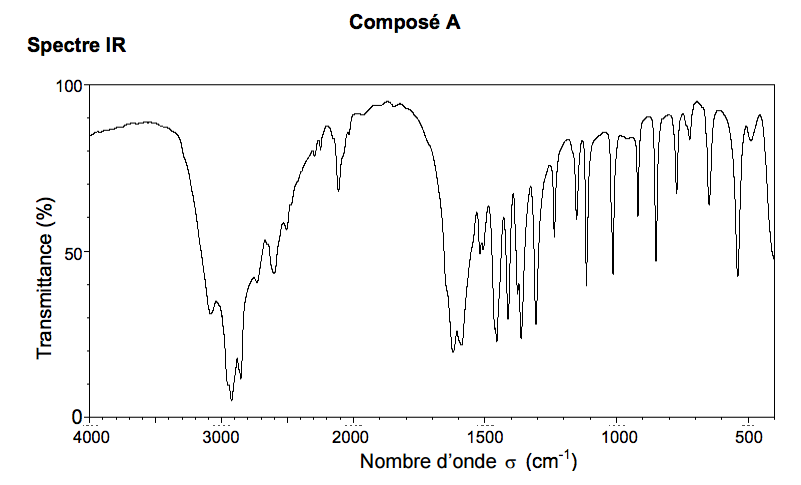
Spectre RMN (obtenu dans des conditions permettant d'éliminer les signaux relatifs à $N-H$ et à $O-H$).
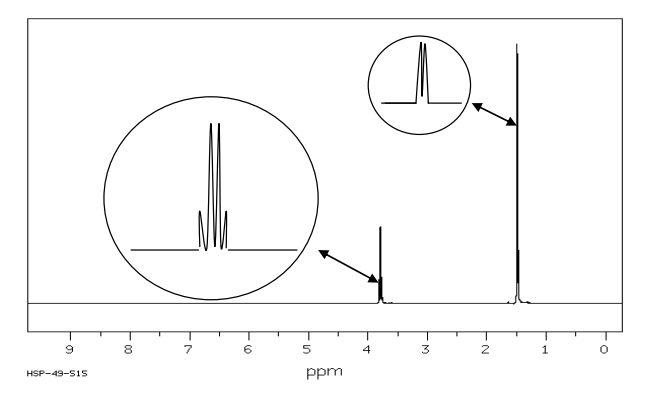
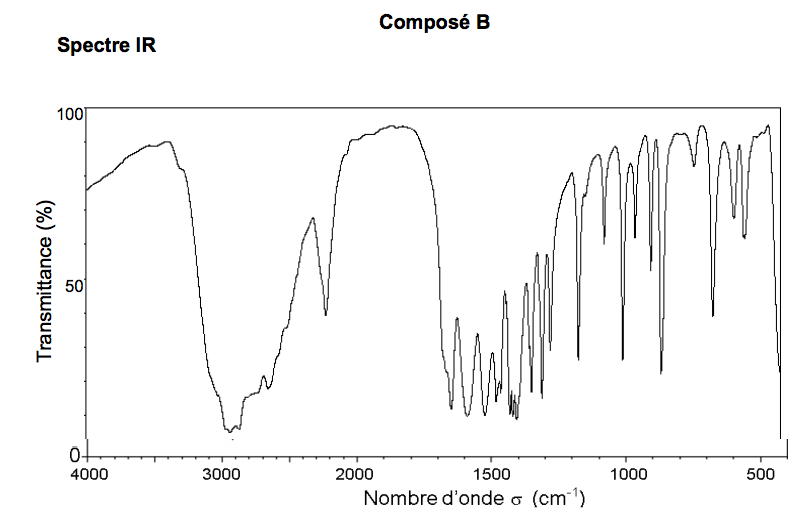
Spectre RMN (obtenu dans des conditions permettant d’éliminer les signaux relatifs à $N-H$ et à $O-H$)
Partie 2 - Spectroscopie infrarouge
Les techniques de spectroscopie reposent sur l’interaction entre un rayonnement électromagnétique et la matière. L’absorption de certaines radiations infrarouges par une molécule organique provoque des vibrations moléculaires. On s’intéresse aux vibrations d’élongation qui correspondent à une modification périodique de la distance entre deux atomes liés. Elles peuvent être étudiées en modélisant une liaison covalente par un oscillateur mécanique.
1) Exemple d’oscillateur mécanique
Un solide de masse $m$ pouvant glisser sans frottement sur une tige horizontale et accroché à un ressort de raideur $k$ comme l’indique la figure ci-dessous, constitue un exemple oscillateur mécanique. La position du solide est repérée sur l’axe $Ox$ par l’abscisse de son centre d’inertie $G$.
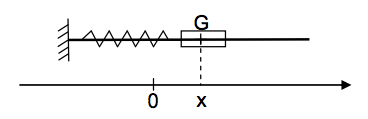
On réalise trois expériences pour étudier l’influence de différents paramètres sur les oscillations. Le solide est écarté de sa position d’équilibre, repérée par l’abscisse $x = 0$, de façon à étirer le ressort, puis est lâché sans vitesse initiale.
L’évolution de la position $x$ en fonction du temps est représentée ci-après pour chaque expérience.
Courbe 1 : $m = 145 \ g$ ; $k = 10 \ N.m^{-1}$
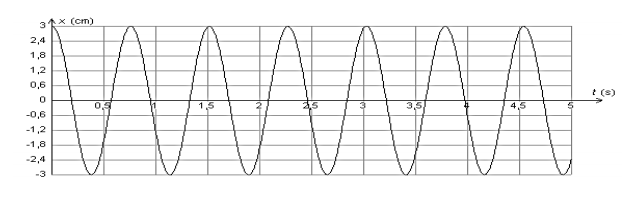
Courbe 2 : $m = 145 \ g$ ; $k = 30 \ N.m^{-1}$
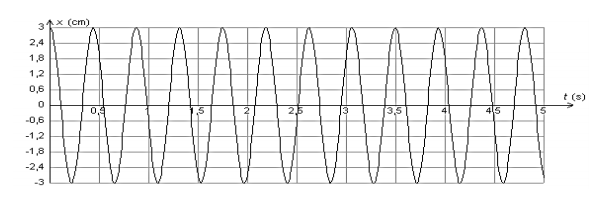
Courbe 3 : $m = 500 \ g$ ; $k = 10 \ N.m^{-1}$
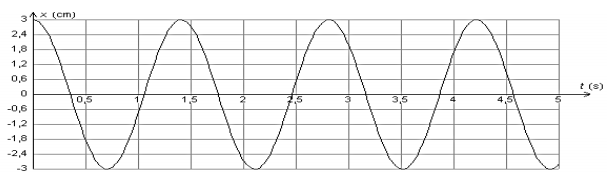
Discuter, d’après les courbes 1 à 3, de l’influence de la masse $m$ du solide et de la constante de raideur $k$ du ressort sur les oscillations.
2) Vibration d’une liaison covalente
La vibration de la liaison de covalence liant deux atomes $A$ et $B$ de masses respectives $m_A$ et $m_B$ est due à l’absorption d’une radiation électromagnétique dont le nombre d’onde $\sigma$ s’exprime par la relation :
$\sigma = \dfrac{1}{2 \pi c} \sqrt{\dfrac{\alpha}{\mu}}$ (loi de Hooke)
avec :
$\mu = \dfrac{m_Am_B}{m_A+m_B}$, mase réduite du système des deux atomes $A$ et $B$ calculée à partir des masses atomiques respectives $m_A$ et $_B$ des atomes $A$ et $B$ et exprimée en $g$ ;
$\alpha$ : constante de force de la liaison exprimée en $g.s^{-2}$ ;
$c$ : célérité de la lumière dans le vide en $cm.s^{-1}$, égale à $3,00 \times 10^{10} \ cm.s^{-1}$ ;
$\sigma$ : nombre d'onde de la radiation absorbée exprimée en $cm^{-1}$
Données :
Masses atomiques :
$m_H = 1,67 \times 10^{-24} \ g$
$m_C = 1,99 \times 10^{-23} \ g$
$m_O = 2,66 \times 10^{-23} \ g$Constante de force de la liaison $C - H$ : $\alpha = 5,0 \times 10^5 \ g.s^{-2}$
Relation liant longueur d'onde et nombre d'onde : $\sigma = \dfrac{1}{\lambda}$
A) Retrouver l’unité du nombre d’onde $\sigma$ par une analyse dimensionnelle.
B) Calculer le nombre d’onde correspondant à la vibration d’élongation d’une liaison $C – H$.
Comparer le résultat aux données.
C) Dans les acides carboxyliques, l’absorption du rayonnement IR par la liaison simple $C – O$ du groupe d’atomes $C – OH$ est observée vers $1300 \ cm^{-1}$ alors que celle de la liaison double $C = O$ est observée aux alentours de $1700 \ cm^{-1}$.
Sachant que les masses réduites des groupes d’atomes $C – OH$ et $C = O$, peuvent être considérées comme étant égales, proposer une explication.
22 éléments
-
1  Constitution et transformation de la matière
Constitution et transformation de la matière
-
2  Constitution et transformation de la matière
Constitution et transformation de la matière
-
3  Constitution et transformation de la matière
Constitution et transformation de la matière
-
4  Constitution et transformation de la matière
Constitution et transformation de la matière
-
5  Constitution et transformation de la matière
Constitution et transformation de la matière
-
6  Constitution et transformation de la matière
Constitution et transformation de la matière
-
7  Constitution et transformation de la matière
Constitution et transformation de la matière
-
8  Constitution et transformation de la matière
Constitution et transformation de la matière
-
9  Constitution et transformation de la matière
Constitution et transformation de la matière
-
10  Constitution et transformation de la matière
Constitution et transformation de la matière
-
11  Constitution et transformation de la matière
Constitution et transformation de la matière
-
12  Constitution et transformation de la matière
Constitution et transformation de la matière
-
13  Constitution et transformation de la matière
Constitution et transformation de la matière
-
14  Constitution et transformation de la matière
Constitution et transformation de la matière
-
15  Constitution et transformation de la matière
Constitution et transformation de la matière
-
16  Constitution et transformation de la matière
Constitution et transformation de la matière
-
17  Constitution et transformation de la matière
Constitution et transformation de la matière
-
18  Constitution et transformation de la matière
Constitution et transformation de la matière
-
19  Constitution et transformation de la matière
Constitution et transformation de la matière
-
20  Constitution et transformation de la matière
Constitution et transformation de la matière
-
21  Constitution et transformation de la matière
Constitution et transformation de la matière
-
22  Constitution et transformation de la matière
Constitution et transformation de la matière
