Terminale > Mission Bac Physique-Chimie > Mes sujets de bac > Constitution et transformation de la matière
CONSTITUTION ET TRANSFORMATION DE LA MATIÈRE
Exercice d'application
Annales
-
L'acide ascorbique, communément appelé vitamine C, est un antioxydant présent dans de nombreux fruits et légumes. Une carence prolongée en vitamine C provoque une maladie appelée scorbut. En pharmacie, il est possible de trouver l'acide ascorbique, sous forme de comprimés de vitamine C 500, chacun contenant 500 mg de vitamine C.
L’objectif de l’exercice est d’étudier une voie de synthèse industrielle de l’acide ascorbique puis de vérifier la valeur de la masse d’acide ascorbique contenue dans un comprimé.
Données :
- données de spectroscopie infrarouge :
Liaison
Nombre d’onde (cm-1)
Caractéristiques de la bande d’absorption
O – H alcool
3200 - 3700
forte, large
O – H acide carboxylique
2500 - 3200
forte à moyenne, large
C–H
2800 - 3100
forte ou moyenne
C=O
1650 - 1740
forte
- masse molaire moléculaire de la vitamine C : M(acide ascorbique) = 176 g.mol-1.
1. Synthèse industrielle de l’acide ascorbique
L’acide ascorbique est synthétisé industriellement à partir du D - Glucose. La synthèse selon le procédé Reichstein se déroule en plusieurs étapes ; un schéma réactionnel simplifié est décrit ci-dessous.
Étape 1 Étape 2Étape 3 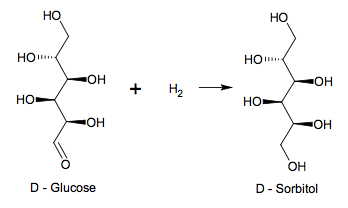
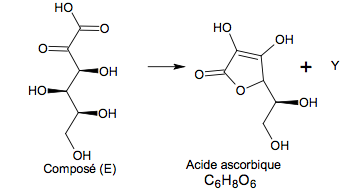
Une oxydation du D - Sorbitol produit le composé (E) de formule topologique :
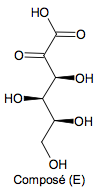
1.1. Étape 1 de la synthèse.
1.1.1. Le passage du D - Glucose au D - Sorbitol correspond-il à une modification de chaîne ou de groupe caractéristique ?
1.1.2. Donner le nom de la catégorie de réaction. Justifier.
1.2. Étape 3 de la synthèse.
1.2.1. Écrire la formule brute du composé (E). 1.2.2. Identifier l’espèce chimique Y et la nommer.
1.3. Le déroulement de la synthèse peut être contrôlé par spectroscopie infrarouge. Attribuer les spectres A et B fournis ci-dessous au D - Sorbitol et à l’acide ascorbique. Justifier.
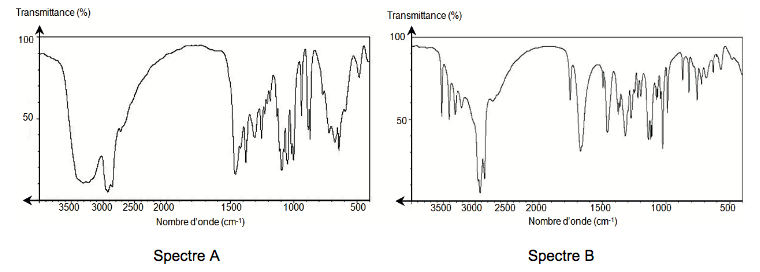
2. Titrage de l’acide ascorbique contenu dans un comprimé de vitamine C 500.
On souhaite vérifier l’indication « vitamine C 500 » figurant sur le tube de comprimés.
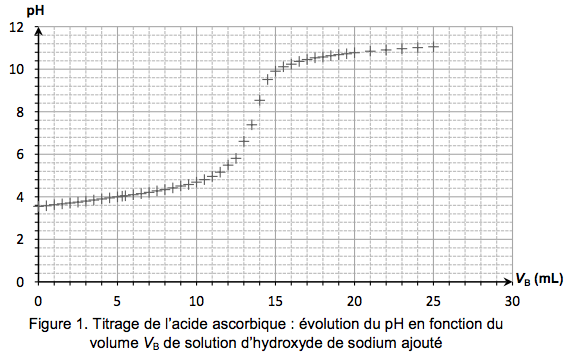
Pour cela, on dissout un comprimé de vitamine C dans de l’eau distillée afin d’obtenir 100,0 mL de solution S. On prélève un volume de 10,0 mL de cette solution S que l'on dose par une solution aqueuse d'hydroxyde de sodium (Na+(aq) + HO-(aq)) de concentration molaire égale à 2,00 × 10-2 mol.L-1. Le titrage est suivi par pH-métrie (figure 1).L’équation de la réaction support du titrage est la-suivante : $C_6H_8O_6 (aq) + HO^- (aq) \rightarrow C_6H_7O_6^- (aq) + H_2O$
2.1. Réaliser un schéma légendé du dispositif expérimental utilisé pour réaliser le titrage.
2.2. Justifier que la réaction support du titrage est une réaction acido-basique.
2.3. Déterminer la concentration molaire en acide ascorbique dans la solution S.
2.4. En déduire la masse $m$ de vitamine C contenue dans un comprimé. Comparer la valeur obtenue à l'indication donnée par le fabricant. Proposer deux sources d’erreurs possibles, liées à la mise en œuvre du titrage, pouvant expliquer l’écart observé.
22 éléments
-
1  Constitution et transformation de la matière
Constitution et transformation de la matière
-
2  Constitution et transformation de la matière
Constitution et transformation de la matière
-
3  Constitution et transformation de la matière
Constitution et transformation de la matière
-
4  Constitution et transformation de la matière
Constitution et transformation de la matière
-
5  Constitution et transformation de la matière
Constitution et transformation de la matière
-
6  Constitution et transformation de la matière
Constitution et transformation de la matière
-
7  Constitution et transformation de la matière
Constitution et transformation de la matière
-
8  Constitution et transformation de la matière
Constitution et transformation de la matière
-
9  Constitution et transformation de la matière
Constitution et transformation de la matière
-
10  Constitution et transformation de la matière
Constitution et transformation de la matière
-
11  Constitution et transformation de la matière
Constitution et transformation de la matière
-
12  Constitution et transformation de la matière
Constitution et transformation de la matière
-
13  Constitution et transformation de la matière
Constitution et transformation de la matière
-
14  Constitution et transformation de la matière
Constitution et transformation de la matière
-
15  Constitution et transformation de la matière
Constitution et transformation de la matière
-
16  Constitution et transformation de la matière
Constitution et transformation de la matière
-
17  Constitution et transformation de la matière
Constitution et transformation de la matière
-
18  Constitution et transformation de la matière
Constitution et transformation de la matière
-
19  Constitution et transformation de la matière
Constitution et transformation de la matière
-
20  Constitution et transformation de la matière
Constitution et transformation de la matière
-
21  Constitution et transformation de la matière
Constitution et transformation de la matière
-
22  Constitution et transformation de la matière
Constitution et transformation de la matière
