Terminale > Physique-Chimie > L’énergie : conversions et transferts > Stage - Système, transferts thermiques
STAGE - SYSTÈME, TRANSFERTS THERMIQUES (Accès libre)
Le système
PermalienDans ce cours, nous allons voir le système en thermodynamique.
I. Définition
Système : un corps ou un ensemble de corps qui est l’objet de notre étude, de l’exercice. Parfois, on note Σ le système.
II. Exemple
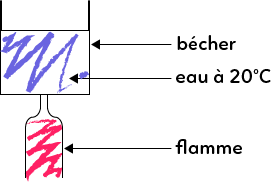
Imaginons que nous avons une flamme qui vient chauffer de l’eau qui se trouve dans un bécher. Le support du bécher et de la flamme ne sont pas représentés ici car c’est purement schématique.
Il y a plusieurs possibilités :
|
Système |
eau |
eau + bécher |
eau + bécher + flamme |
|
échange d’énergie |
reçoit de l’énergie termique ΔU>O |
reçoit de l’énergie termique ΔU>O |
ne reçoit pas d’énergie termique ΔU=O |
On peut soit considérer que le système est uniquement l’eau ou alors l’eau plus le bécher ou alors l’eau plus le bécher plus la flamme. C’est extrêmement important de faire ce choix là dès le début de l’exercice parce que, de cela dépend tout le traitement de l’exercice.
Voici un exemple : si on se pose la question s’il y a échange d’énergie. Est-ce qu’il y a de l’énergie qui arrive ou qui part du système ?
Si le système est l’eau, très clairement, l’eau reçoit de l’énergie car le bécher est réchauffé grâce à l’action de la flamme.
Si le système est l’eau+bécher, les deux vont se faire réchauffer par la flamme donc le système eau+bécher reçoit de l’énergie, sa température va monter.
Et, si le système c’est l’eau+bécher+flamme, est-ce qu’il y a de l’énergie qui vient de l’extérieur ? Non !
Alors, on peut dire qu’il y a un échange énergétique avec le gaz qui se trouve dans la pièce, mais on fait abstraction de cet échange possible. Il n’y a pas d’énergie qui provient de la flamme car la flamme fait elle-même partie du système. Si on raisonne en termes d’énergie interne, l’énergie interne du premier et du second système augmente puisque l’énergie augmente (ΔU>0). Mais, l’énergie interne de ce troisième système, qui ne subit aucune source de chaleur extérieure, est constante : ΔU=0.
C’est donc extrêmement important de bien déterminer le système dès le départ.
III. Vocabulaire
Mots de vocabulaire sur le système qu’il faut absolument connaître ainsi que leur signification :
A. Le système ouvert
Un système qui est ouvert peut vouloir dire qu’il peut échanger de l’énergie avec l’extérieur (pas obligatoire) : énergie thermique (quantité de chaleur), mécanique (travail), électrique (générateur par exemple) ou chimique (réactions exothermiques). Un système ouvert peut aussi échanger de la matière car il est justement ouvert. Sa quantité de matière reçue peut augmenter ou diminuer. Par exemple, un gaz dans une tuyère d’avion. A chaque instant il y a de l’injection de gaz qui a lieu et à chaque instant il y a des échanges énergétiques car il y a de la combustion, décompression, etc.
B. Le système fermé
Celui-ci ne peut qu’échanger de l’énergie, mais ça n’est pas une obligation. Par exemple, à l’intérieur d’une cocotte-minute fermée hermétique, les parois sont solides et ne peuvent pas bouger. Il ne peut pas y avoir de l’eau qui rentre ou de l’eau qui sort. On fait l’hypothèse que la cocotte-minute soit vraiment fermée hermétiquement avec le bouchon scotché, qui ne bouge pas. C’est un système fermé, donc, car la seule chose qui peut lui arriver c’est recevoir de l’énergie de l’extérieur, par la conduction thermique par la partie métallique de la cocotte-minute. En aucun cas il n’y aura échange de matière.
C. Le système isolé
On parle de système isolé dans le cas où le système ne peut ni recevoir ni échanger de la matière. Pas d’échanges avec l’extérieur ! Par exemple, à l’intérieur des parois solides et calorifugées. C’est un exemple qui reviend souvent dans les exercices. « Calorifugé » signifie qu’il n’y a pas d’échange de chaleur, pas d’échange thermique. Pas d’échange mécanique et si les parois sont fermées, il n’y a pas d’échange de matière.




